Eine überaus wichtige Ressource für die Untersuchung von Erkrankungen sind Gewebeproben, welche aus diagnostischen und therapeutischen Gründen Patienten und Patientinnen entnommen wurden.
In der zentralen Gewebe-Biobank des USZ befinden sich sowohl Formalin fixierte, aber auch unfixierte und tiefgefrorene Gewebeproben gelagert werden. Parallel sind die entsprechenden pathologischen Befunde in verschlüsselter Form in einer Datenbank erfasst. Die Gewebe-Biobank wird sowohl für diagnostische Fragestellungen, Forschungsprojekte als auch für klinische Studien benützt, um dem Auftrag des USZ nachzukommen.
Die zentrale Gewebe-Biobank unterstützt translationale Krebsforschungsprojekte des University Research Priority Programms (URPP) und des Kompetenzzentrums für Personalisierte Medizin (CC-PM).
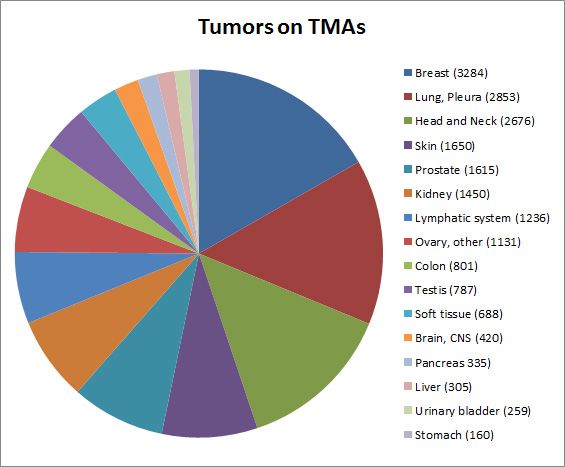
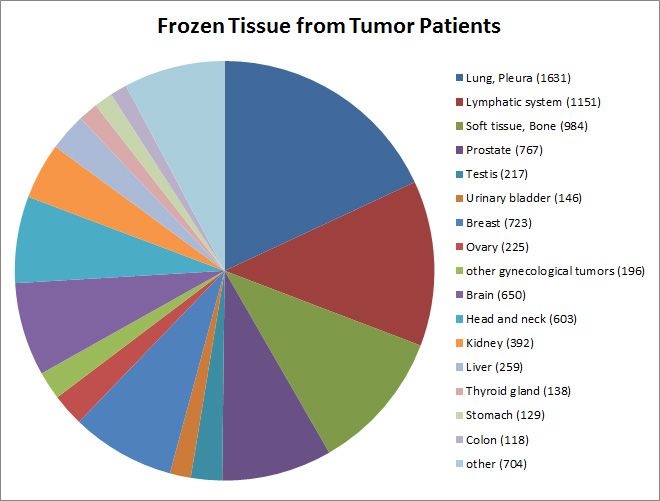
Über 200 Gewebechips (TMAs) mit Gewebestanzen von 40’000 Patientinnen und Patienten wurden generiert. Die grössten TMAs bestehen aus Mammakarzinomen (>2’000 Proben), Lungenkarzinomen (>1’000) und Nierenzellkarzinomen (>1’000). 4’500 immunhistochemisch gefärbte TMAs wurden elektronisch archiviert. Ausserdem werden etwa 16’000 Gewebeproben von über 9’000 Patientinnen und Patienten tiefgefroren gelagert. 75 authentifizierte Tumorzelllinien sowie 50 primäre Tumorzellkulturen stehen ebenfalls zur Verfügung.
Patientenaufklärung und -einwilligung
Für die Aufbewahrung und Weiterverwendung von biologischem Material und von Daten für die biomedizinische Forschung am USZ bedarf es der Aufklärung der Patientinnen und Patienten. Hierzu werden die Patientinnen und Patienten über ihre Rechte, die Bedeutung ihrer Einwilligung sowie über eventuelle Nutzung ihrer Gewebeproben und Daten für zukünftige Forschungsprojekte informiert.
Mit der Unterzeichnung des Einwilligungsformulars gibt der Patient oder die Patientin seine oder ihre Zustimmung, seine oder ihre Gewebeprobe(n) in der Gewebe-Biobank lagern und diese zusammen mit seinen oder ihren Daten für zukünftige Forschungsprojekte nutzen zu dürfen.
Patientenaufklärung und EinwilligungGesetze, Reglement und Ethik
Gemäss HFG wurde ein Reglement erstellt, welches die wesentlichen Punkte für den Betrieb der Gewebe-Biobank (Personal, Strukturen, Qualitätssicherungssystem, Gewährleistung des Datenschutzes, Schutz der Persönlichkeitsrechte) regelt.
Nach gesetzlicher Bestimmung muss jedes Forschungsprojekt, bei dem Gewebeproben und Patientendaten aus der Gewebe-Biobank angefordert werden, zuvor von der Kantonalen Ethikkommission des Kantons Zürich bewilligt werden.
Qualitätsmanagement
Die Gewebe-Biobank ist Teil des Instituts für Pathologie und Molekularpathologie. Die Standardisierung der Prozesse bezüglich Weiterverarbeitung, Qualitätstests und Lagerung ist Voraussetzung für die Qualitätssicherung in der Gewebe-Biobank.
Das Qualitätsmanagement der Gewebe-Biobank umfasst im Wesentlichen drei Hauptprozesse:
A) Herstellung von Gewebe- und Zellmikroarrays
B) Sammeln und Lagern von gefrorenen Gewebeproben und primären Tumorzellkulturen
C) Herausgabe von Gewebeproben und -daten
A) Herstellung von Gewebe- und Zellmikroarrays (TMAs und CMAs)
Um die meist durch Experimente mit Zelllinien oder Tiermodellen gewonnenen Erkenntnisse von Krankheiten für Patienten nutzen zu können, sind Untersuchungen von zahlreichen menschlichen Geweben notwendig. Analysen von Gewebeproben auf Gewebechips (Tissue Microarrays) verknüpft mit pathologischen und klinischen Daten ermöglichen eine rasche Identifizierung von potentiellen Biomarkern für Krankheiten. Dies trägt dazu bei, Diagnose- und Therapiemöglichkeiten zu optimieren.
Neben TMAs können auch Zellblöcke von Zellkulturen für die Herstellung von Zellchips (Cell Microarrays) verwendet werden. Kombinationen von Zellkulturen und Gewebe derselben Patienten können dadurch generiert und für weitere Tests und Validierungen herangezogen werden. CMAs eignen sich auch sehr gut für immunhistochemische Antikörpertestungen an Paraffinmaterial, was einer unnützen Verschwendung von wertvollem Gewebematerial entgegenkommt.
B) Sammeln und Lagern von gefrorenen Gewebeproben und primären Tumorzellkulturen
Da Formalin Nukleinsäuren in Gewebezellen chemisch modifiziert und zersetzt, sind die Möglichkeiten für molekulare Analysen von DNA oder RNA eingeschränkt. Es ist daher wichtig, Gewebeproben auch in unfixiertem, gefrorenem Zustand aufzubewahren. Die hochmolekularen Strukturen von DNA, RNA und Proteinen werden dadurch wenig verändert, was für molekularbiologische Untersuchungen von enormer Bedeutung ist. In der Gewebe-Biobank werden Gewebeproben tiefgekühlt gelagert, welche bestimmte Qualitätskriterien (z.B. Morphologie, Biopsiegrösse, Anteil Tumorzellen) erfüllen. Dadurch werden Qualitätsansprüche an Gewebeproben bei zukünftigen Forschungsprojekten berücksichtigt.
Für die meisten Zellkulturen von Primärtumoren wurden mittlerweile Protokolle etabliert. Dies schliesst vor allem Zellkulturen von Krebspatienten ein, welche mit zielgerichtetenTherapien behandelt werden. Früh passagierte Zellkulturen werden von Tumorgeweben generiert, um Tumorheterogenität oder die Wirkung von Therapeutika zu untersuchen.
C) Herausgabe von Gewebeproben und -daten
Die in Datenbanken gespeicherte Dokumentation von Gewebeproben und Gewebechips sind wichtige Voraussetzungen für deren Nutzung zu Forschungszwecken. Die Herausgabe von Gewebeproben und -daten erfolgt nach einem standardisierten Prozess, bei dem wissenschaftliche, rechtliche und ethische Aspekte berücksichtigt werden.

